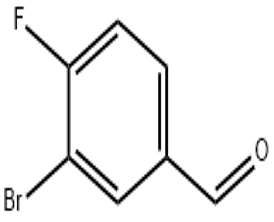
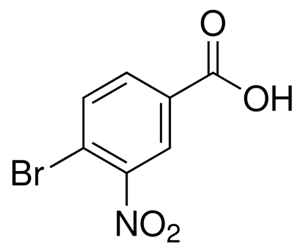
алфа-јонон (ЦАС#127-41-3)
| Кодови ризика | Р42/43 – Може изазвати преосетљивост удисањем и контактом са кожом. |
| Безбедносни опис | С24/25 – Избегавати контакт са кожом и очима. |
| ВГК Немачка | 2 |
| РТЕЦС | ЕН0525000 |
| ТСЦА | Да |
| ХС код | 29142300 |
алфа-јонон(ЦАС#127-41-3) информације
Љубичасти кетон, такође познат као бензофенон, је органско једињење. Ево неколико безбедносних информација о јонону:
1. Токсичност: Љубичасти кетон има одређену токсичност за људско тело. Може изазвати оштећење централног нервног система и јетре и може имати штетне ефекте на репродуктивни систем и ембрионе.
2. Опасност од удисања: Удисање паре или прашине јонона може изазвати симптоме нелагодности као што су вртоглавица, поспаност, кашаљ и отежано дисање. Дуготрајно излагање може изазвати оштећење централног нервног система.
3. Опасност од контакта: Љубичасти кетон се може апсорбовати кроз кожу. Дуготрајан или опсежан контакт може изазвати иритацију коже и очију. При руковању јононом треба носити одговарајућу личну заштитну опрему као што су рукавице и заштитне наочаре.
4. Мере за гашење пожара: У случају цурења или пожара, за гашење пожара употребити суви прах, пену или угљен-диоксид. Избегавајте употребу воде, јер љубичасти кетон реагује са водом и производи запаљиве гасове.
5. Одлагање отпада: Одложите отпадни љубичасти кетон на одговарајући начин у складу са локалним прописима и правилима. Немојте га испуштати у канализацију или канту за смеће.
6. Мере предострожности за складиштење: Љубичасти кетон треба чувати на хладном, сувом, добро проветреном месту, даље од извора ватре и оксиданата.
Ове информације су само за референцу. Ако је потребна даља употреба или обрада јонона, погледајте релевантни безбедносни лист и консултујте стручњака.
природа
Љубичасти кетон, такође познат као линаилкетон, је природно једињење кетона. То је главна компонента ароме цвећа љубичице.
Љубичасти кетон је безбојна до бледо жута уљаста течност која је испарљива на собној температури.
Љубичасти кетон је растворљив у алкохолу и етарским растварачима, а слабо растворљив у води. Његова густина је релативно мала, са густином од 0,87 г/цм³. Осетљив је на светлост и може да апсорбује ултраљубичасте зраке.
Љубичасти кетон се може оксидовати у кетонске алкохоле или киселине у хемијским реакцијама, а може се редуковати у алкохоле реакцијама редукције хидрогенације. Може да се подвргне реакцијама алкилације и естерификације са многим једињењима.
Примена и метода синтезе
Љубичасти кетон (такође познат као љубичасти кетон) је ароматично једињење кетона. Има посебан мирис и често се користи у индустрији парфема и парфема. Следи увод у употребу и методе синтезе јонона:
сврха:
Парфеми и зачини: карактеристике мириса јонона, који се нашироко користи у индустрији парфема и зачина за производњу љубичастих мирисних производа.
Метод синтезе:
Синтеза јонона се генерално постиже помоћу следеће две методе:
Оксидација нуклеобензена: Нуклеобензен (бензенски прстен са метил супституентом) се подвргава реакцији оксидације, као што је коришћење оксидационе киселине или киселог раствора калијум перманганата, да би се добио јонон.
Спајање пирилбензалдехида: Пирилбензалдехид (као што је бензалдехид са супституентима пиридинског прстена у пара или мета положају) реагује са анхидридом сирћетне киселине и другим реактантима под алкалним условима да би се формирао јонон.